

尿路感染(urinary tract infections,UTIs)是最常见的感染性疾病之一,并且它们还容易反复复发。大多数UTIs因肠道大肠杆菌散播到泌尿道引起。圣路易斯华盛顿大学最新发现,一种分子诱饵可靶向减少肠道UTIs细菌,治疗UTIs。
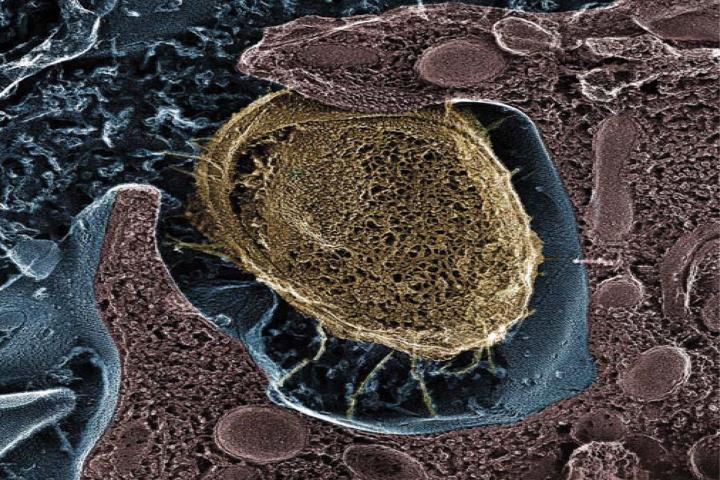
一只住在膀胱壁上的大肠杆菌(黄色)
尿路感染(urinary tract infections,UTIs)是最常见的感染性疾病之一,它们容易反复复发。大多数UTIs因肠道大肠杆菌散播到泌尿道引起。每年全球近1亿人口受UTIs困扰。数据显示,尽管患者接受了抗生素治疗,6个月内(一般约1个季度)仍容易再次感染。UTIs引起疼痛、灼痛和尿频。严重情况还会扩散到肾脏和血液,危及生命。
圣路易斯华盛顿大学最新发现,一种分子诱饵可靶向减少肠道UTIs细菌。研究发现,肠道致病细菌(uropathogenic Escherichia coli,UPEC)数量越少,患UTIs风险越低。“我们研究的最终目标是帮助患者控制和预防复发性尿路感染,同时帮助解决抗生素耐药全球危机,”文章通讯作者“分子微生物学Helen L. Stoever教授”Scott J. Hultgren博士说道。“无需抗生素,该复合物可有效治疗UTIs。”这项研究发表于6月14日的《Nature》杂志。
大多数UTIs由肠道大肠杆菌引起,大肠杆菌在肠道没有危害,但当它们从粪便中脱落扩散到尿道口和膀胱后,就会引发疾病。传统观点认为,UTIs经常发生的原因是,肠道菌群不断重复向尿路播种细菌。
Hultgren、研究生Caitlin Spaulding和他们的同事认为,如果能减少肠道内危险大肠杆菌数量,可从源头减少UTIs发生,并预防一些复发性感染。
首先,研究人员需要鉴定让大肠杆菌在肠道存活下来的基因。一组菌毛(pilus)编码基因进入了科学家们视线。菌毛生长在大肠杆菌表面,帮助细菌刺入组织,没有菌毛,细菌无法在肠道茁壮成长。
早期研究发现,菌毛附着于一种被称为“甘露糖(mannose)”的糖类,细菌抓住膀胱表面的甘露糖避免随尿液排出。缺少菌毛的细菌无法引起老鼠UTIs。
此前,Hultgren和生化&分子生物物理学教授James W. Janetka博士,化学改性了甘露糖为多价甘露糖苷(mannosides)。细菌菌毛与甘露糖苷的附着作用更为紧密,但甘露糖苷并不附着于膀胱壁。抓住甘露糖苷后,细菌很容易被尿液冲出。
研究人员发现菌毛也有助于细菌与肠道壁结合,因此推测,甘露糖苷能降低肠道大肠杆菌数量,减少传播几率。
为了验证这一想法,他们将致病大肠杆菌(该细菌可在UTIs患者的膀胱和肠道被同时检出)引入老鼠肠道和膀胱。
随后让老鼠口服三个剂量甘露糖苷,研究人员发现,膀胱内的致病细菌几乎完全被消灭了,肠道内的细菌数量减少了100%(每个检测样本从1亿下降到100万)。
大多数大肠杆菌和相关菌种都有这种类型的菌毛。理论上,甘露糖苷疗法可扫除一系列肠道细菌,与抗生素可同时杀死好几种细菌的效果相比,有异曲同工之妙。但是,抗生素容易杀伤益生菌,让危险微生物有可乘之机,这是广谱抗生素治疗的风险之一。
研究人员测量了接受甘露糖苷治疗后老鼠肠道微生物群组成,发现甘露糖苷几乎只影响引起UTIs的细菌,对其他肠道细菌影响很小。尤其与抗生素治疗后老鼠肠道多种微生物群落大量变化形成鲜明对比。
“这是一个令人兴奋的发现。我们开发了一种全新的治疗手段,就像分子手术刀,特异性地切断你想甩掉的细菌,其他微生物群落则完好无损。”
此外,甘露糖苷不是抗生素,可被用于耐药细菌引发的UTIs。在美国,每年约9%耐药案例发生在UTIs患者身上。避免UTIs患者使用抗生素,可帮助耐药菌的出现和传播。
然而,老鼠和女性生理结构和生活行为都有差异,因此甘露糖苷是否能减少人类UTIs反复感染次数,仍需进行人体实验。
《本文转载生物通》