如何选择合适的荧光蛋白
发布人:admin
浏览次数:1509
发布时间:2017-11-23
自 1992 年绿色荧光蛋白被用于标记基因,各种颜色的荧光蛋白被开发出,目前有上百种的荧光蛋白。
在我们的实验中,经常会用到荧光蛋白,但是如何选择合适荧光蛋白,得到完美的实验结果?相信这个问题一直困扰着大家,鉴于此,小编从不同的角度去考虑如何选择荧光蛋白,希望可以给大家在选择荧光蛋白方面提供一些帮助。

Tubes of various fluorescent proteins displayed in a box with UV light shining on them.
单体性质
将荧光蛋白与目标蛋白进行融合表达,直接地追踪目标蛋白或是定位目标蛋白,这就要求荧光蛋白是单体,不能影响目标蛋白的功能和定位。因此,我们将荧光蛋白的单体性质放在第一位。
目前体外检测荧光蛋白单体性质的方法有分子筛、沉降平衡,可以通过荧光蛋白分子筛的峰图是否狭窄,单一粗略的判断其是否为单体,沉降平衡能够更加准确的确认其聚合性质。我们使用荧光蛋白几乎都是在细胞内或组织内,因此我们更加关心在生理条件下,荧光蛋白的聚合性质。
科学家巧妙地将荧光蛋白与细胞色素 P450 进行融合表达,让荧光蛋白定位在内质网的胞质面,荧光蛋白的聚合性质会使邻近的荧光蛋白聚合在一起,形成聚集体,在激光共聚焦显微镜下能够看到细胞核的周围有很大的点状结构。小编已经用此种方法检测了多个荧光蛋白。
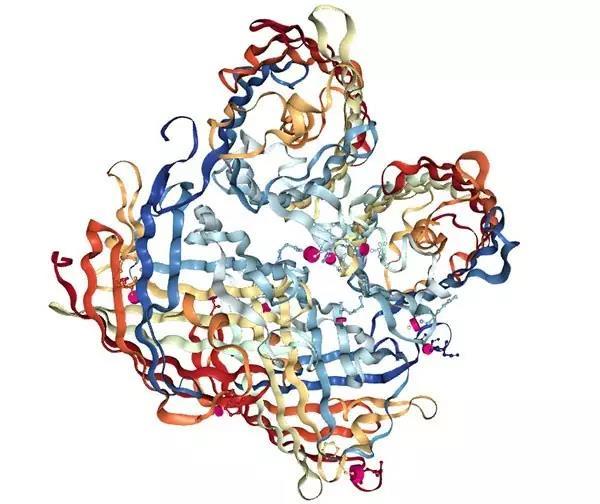
The structure of mEos2
小编发现绿色荧光蛋白中,单体性质比较好的是 mEmerald,该蛋白很少形成大的点状结构,并且目前还没有称该蛋白会影响定位的报道。
此外 mEmerald 是一个非常稳定的绿色荧光蛋白,因此可以用于线性的结构光照明超分辨荧光显微成像。
我们还发现红色荧光蛋白中没有一个单体性质特别好,相比较来说,mApple 的单体性质最好,但是在使用该蛋白的过程中,发现 mAppple 会影响某些蛋白的定位,因此在使用红色荧光蛋白时,要谨记红色荧光蛋白可能会影响目标蛋白的定位。
PK 值
每个荧光蛋白都有其最合适的 pH 值,即在一定的 pH 值下,荧光强度最高。有的荧光蛋白适合在酸性环境下使用,相反有的适合在碱性环境下使用,因此在选择荧光蛋白时需要考虑荧光蛋白的 PK 值。
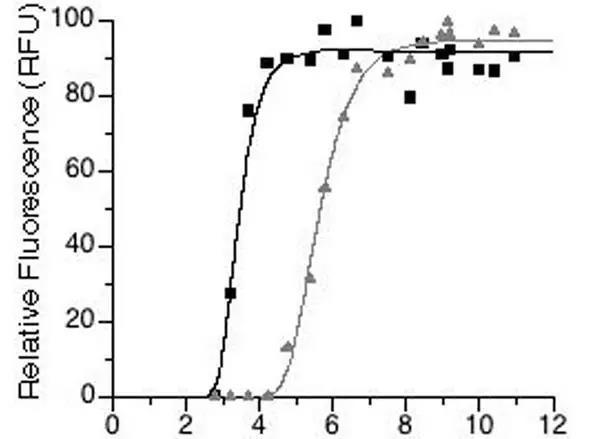
Change in relative fluorescence intensity(RFU)with pH for eGFP(grey triangles)and bfloGFPa1(black squares)
在细胞内,大多数细胞器内及细胞质的 pH 值都在 7.0 左右,然而溶酶体内的 pH 值就比较低,因此常规的荧光蛋白并不适合用于标记溶酶体内的蛋白。
mCherry 的 PK 值比较低,适合在酸性的环境下使用,可以用于标记溶酶体内的蛋白,但是该荧光蛋白有一定的二聚性质,可能会影响目标蛋白的定位,在使用该荧光蛋白时要综合考虑单体性质和 PK 值。
在选择荧光蛋白时,要考虑目标蛋白定位环境的 pH 值,再考虑使用相应 PK 值的荧光蛋白。同时也可以考虑利用荧光蛋白的 PK 值的特性,帮助我们解决问题。
成熟时间
荧光蛋白在发光之前需要经历转录、翻译、折叠等步骤,其中折叠过程占据了大部分时间,我们将此过程称之为成熟时间。在标记短寿命的目标蛋白时,如果荧光蛋白的成熟时间太长,可能会出现在目标蛋白开始降解时,荧光蛋白还没有发光,导致无法追踪及定位目标蛋白。因此在选择荧光蛋白时,需要考虑其成熟时间。
小编在实验时发现,mEmerald、Dendra2 的成熟时间比较快,在用 Lipo2000 转染试剂盒转染 U2OS 细胞时,转染后四个小时就能够用荧光显微镜观察到了荧光信号,EGFP 没有信号。但是在用 P450 方法检测时,Dendra2 会形成很大的聚集,表明该荧光蛋白的单体性质不好,有可能影响目标蛋白的定位和功能,在使用该蛋白的过程中应该注意这个特性。
为了能够更早地观察某些短寿命荧光蛋白的生理特性和定位情况,科学家正在发展成熟时间更快的荧光蛋白,并且用于超分辨成像。
光稳定性
荧光蛋白在发光的同时会被漂白,逐渐失去发光能力,因此要想获得更多的信息,就需要荧光的光稳定性好。在普通的荧光成像中,对荧光蛋白的光稳定性要求并不是很高,比如激光共聚焦显微镜成像时,荧光信号的稳定性只需要能保证采集的完整的一张图即可。
在超分辨荧光成像中,对荧光蛋白的光稳定性要求比较高。线性结构光照明显微镜要求荧光蛋白始终处于亮的状态,需要通过结构光采集多幅图进行重构;非线性结构光显微镜则要求荧光蛋白在黑亮之间进行多次切换,这就要求荧光蛋白能进行反复的光调控,并且依旧维持着高的亮度;与非线性结构光显微镜一样,可逆饱和光线性荧光转移显微镜也要求荧光蛋白能够在黑亮之间进行反复的光调控。
优化密码子
大多数荧光蛋白是来自于海洋生物,因此密码子偏好性与所要标记蛋白的物种有较大的差异,这种密码子偏好性差异可能会导致荧光蛋白在哺乳动物细胞或组织中的表达量极低,以至于看不到荧光信号。
幸运的是大多数荧光蛋白的密码子已经经过优化,适合在哺乳动物细胞中进行融合表达。但是当需要使用荧光蛋白在其他种属细胞内表达时,应考虑一下密码子偏好性。
小编在进行线虫荧光成像时,就遇到过此类问题,没有优化密码子时,荧光蛋白的表达量比较弱,在荧光蛋白经过密码密码子优化,并且在 DNA 序列之间插入线虫的内含子后,荧光蛋白的表达量得到了较大的提高。
在比较少见的物种进行荧光成像时,需要把密码子优化这个特性考虑在内。
N 端或 C 端
在选择了相应的荧光蛋白后,我们需要确定把目标蛋白放在荧光蛋白的 N 端或是 C 端。N 端与 C 端的区别在于目的蛋白,有的目的蛋白对这个要求不高,但某些目的蛋白就要求在特定的位置进行融合表达。
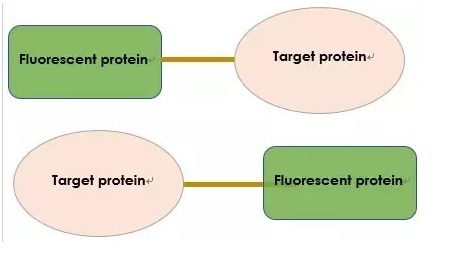
荧光蛋白与目的蛋白融合表达可能会影响目的蛋白的折叠,这取决于目的蛋白折叠过程中,荧光蛋白所在的那一端有没有参与蛋白质的折叠。
例如,如果目的蛋白的 C 端会被折叠入目的蛋白的内侧,那么我们把荧光蛋白标记在目的蛋白的 C 端,将获得不到荧光信号;有些目的蛋白在后翻译的过程会切掉一段,如果荧光蛋白处于被切的一端,那么就不能获得准确的目的蛋白的定位信息。
如果标记的目的蛋白是一个新的蛋白,我们建议分别进行 N 端和 C 端融合表达,以此来确定哪一个是最好的选择。除此之外,还可以用免疫荧光来确认目的蛋白定位是否与荧光蛋白融合表达的一致。
综合以上的介绍,在我们选择荧光蛋白时,首要考虑的是荧光蛋白的聚合性质,即是否会影响目的蛋白的功能及定位,其次是荧光蛋白的 PK 值是否与目的蛋白所处的环境的 pH 值相匹配,然后是荧光蛋白的成熟时间以及目的蛋白的寿命,综合两者决定荧光蛋白是否合适,最后考虑荧光蛋白的光稳定性、密码子偏好性是否合适,最后考虑目的蛋白放的位置,荧光蛋白是否会影响目的蛋白的功能及定位。
此外,在进行荧光成像时,需要考虑显微镜所选的滤光片是否与相应的荧光蛋白质配套,显微镜的各种参数是否合适。值得提醒的是,激发光的强度不能太高,否则会导致荧光信号的漂白。
(本文转载丁香通)







