

造血干细胞(HSC)微环境是一个复杂的环境,它在支持静态造血干细胞生存的同时,也支持了造血细胞补给过程中前体细胞的扩增、分化和迁移。1,2 支持骨内膜微环境中最原始造血干细胞的基质细胞实际上是成纤维细胞、表达CXCL12/SDF-1的网状细胞、内皮细胞和骨形成造骨细胞的混合物。1,2 最近,有研究显示骨吸收破骨细胞也在微环境中起作用。3目前的证据表明此项作用涉及到造血的跨膜酪氨酸磷酸酶CD45。
CD45存在于所有造血细胞的表面,包括造血干细胞和破骨细胞,它们是造血起源的。4,5 在它的底物中,Src家族激酶(SFK)是研究得最为深入的一种CD45底物。CD45可正向或负向影响SFK的活性,取决于它脱去了哪个磷酸酪氨酸上的磷酸基团。5 人体中CD45的缺失突变与严重的免疫缺陷相关。这主要是由于T细胞上CD45的缺失,正常情况下CD45本应大量存在。T细胞上的CD45是抗原反应中调节SFK活性所必需的。5 CD45缺陷型(CD45-/-)小鼠骨髓中含有正常数量的造血细胞,但最原始造血干细胞在数量上减少,而它们对G-CSF的响应动员也受损。4 在某种程度上,这种缺陷是这种造血干细胞固有的特征;没有了CD45介导的SFK活性的下调,整合素介导的粘附相应升高,而造血干细胞则更趋向于停留在微环境中。CD45-/-缺陷的造血干细胞对G-CSF刺激动员和趋化因子CXCL12/SDF-1诱导的归巢都不响应,它负向影响了移植后的细胞植入。4 这些缺陷能通过补充SFK抑制剂而重建修复,意味着此项作用通常是由CD45执行的。
4 同样地,CD45缺陷型(CD45-/-)受体也表现出植入缺陷及随后正常造血干细胞的动员缺陷,显示出CD45在微环境以及造血干细胞中的作用。4 尽管G-CSF被广泛用于诱导干细胞动员进入外周循环,但许多其他的“压力信号"也有着动员效应。6 TRANCE(TNF相关的激活诱导因子),也称为RANK L(NF-kB配体的受体激活剂)就是这样一种动员剂。3,4 然而,在CD45-/-小鼠中,RANK L不再能动员造血干细胞。由于破骨细胞是微环境中表达RANK L受体的主要细胞类型,这显示破骨细胞CD45参与RANK L诱导的动员中。4 RANK L更被人熟知的是作为破骨细胞分化所必需的调节因子,而此项功能在CD45-/-小鼠中同样表现为受损。除了异常的形态和微环境重塑,CD45-/-破骨细胞显示出G-CSF刺激的金属蛋白酶分泌受损,以及RANK L刺激的骨桥蛋白降解的减少,和可溶性干细胞因子(SCF;c-kit配体)释放的下降。4 这些事件已知是由SFK调节的,对造血干细胞动员很重要。
尽管CD45在SFK及其它底物的去磷酸化上作用已经在多种白细胞中得到证实,但CD45在破骨细胞中的作用却是新发现。5 关于CD45还存在一些问题,尚未得到解答,包括其高度可调地表达其同型及其他分化糖基化形式的内在原因,以及鉴别其潜在的细胞外配体。不过,破骨细胞CD45在骨内膜微环境体系和造血干细胞动员中的参与为研究人员提供了新的线索,表明破骨细胞扮演的角色,无论是直接还是间接,对造血干细胞的动态平衡都很重要。
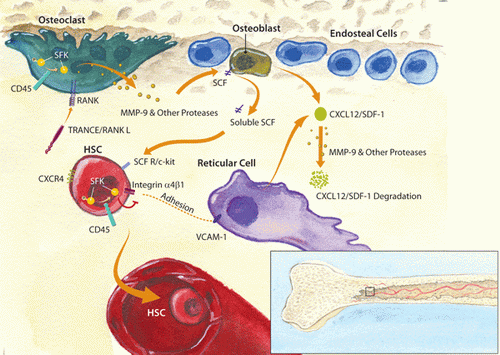
CD45去磷酸化并下调了造血干细胞中Src家族激酶(SFK)的活性。这同时降低了整合素活性和粘附,如造血干细胞α4β1和网状细胞VCAM-1之间。CD45还下调了破骨细胞的SFK活性,让TRANCE/RANK L去诱导MMP-9及其他蛋白酶的分泌。这些蛋白酶催化了可溶的干细胞因子(SCF)从造骨细胞中释放及CXCL12/SDF-1的降解,这些通常是分别与造血干细胞SCF R/c-kit和CXCR4相互作用。这些相互作用的丧失导致了造血干细胞从骨髓到血液的动员。