细胞在肿瘤、病毒、细菌、寄生虫、移植组织、过敏原、甚至自身抗原的适应性免疫应答中都发挥着重要的调节作用。大部分 T 淋巴细胞在其细胞表面表达单一的、高度特异性的抗原受体(TCR),与 MHC-抗原肽复合物相结合并识别其中特异的抗原肽,启动获得性/特异性免疫应答机制,比如 T 细胞介导的细胞免疫和 B 细胞介导的体液免疫。
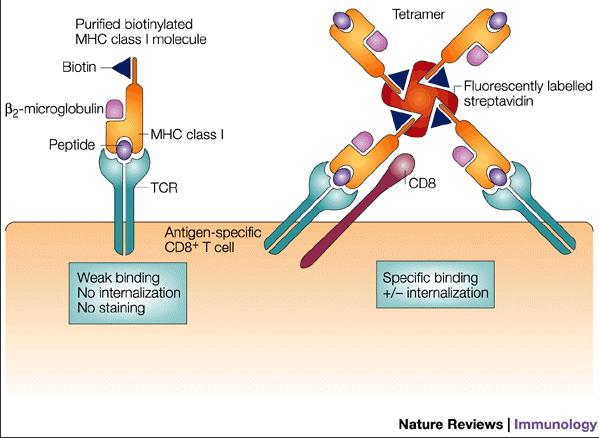
由于 TCR 与 MHC-抗原肽复合物之间的亲和力低,半衰期短,相互结合后容易快速脱落,重组的可溶性 MHC-抗原肽复合物单体并不适合用于抗原特异性的 T 细胞检测。
1996 年,美国斯坦福大学 John D. Altman 博士等人开发出 MHC-抗原肽复合物四聚体(简称:MHC 四聚体)技术。该技术由 4 个 MHC-抗原肽单体分子及荧光染料组成的复合物,它以带有信号标记的链霉亲合素为基础,交联四个 MHC 分子单体,形成 MHC 四聚体;一个 MHC 四聚体分子可与同一 T 细胞表面的 3-4 个 TCR 相识别并结合,从而大大增强了 MHC-抗原肽复合物与 TCR 之间的结合力和检测特异性,并可通过流式细胞术成功实现对抗原特异性的 T 细胞的离体分析。
如今,MHC 四聚体技术已成为 T 细胞免疫应答定量的「金标准」。它极高的灵敏度和抗原特异性,适用于一些相关的基础研究和临床应用,包括:特异性 T 细胞高效分选;抗原表位短肽亲和力筛选;病毒逃避免疫机制研究;T 细胞表面受体 TCR 亲和力研究;可作为分子标记,应用于「T-Cell Receptor-Like Antibodies」筛选研究;MHC 免疫功能研究等。
MHC 四聚体已广泛应用于疫苗研发;细胞治疗研究等。并具备诊断试剂开发潜能。
四聚体技术优势
与其他应用于 T 细胞检测的传统方法相比,如酶联免疫斑点检测(ELISPOT)、单细胞 PCR 等,MHC 四聚体分析技术具有以下优势:
高灵敏度:可检测血液中低丰度(≤1%)的抗原特异性 T 细胞
高特异性:极大提高了 TCR 与 MHC-抗原多肽复合物结合的特异性
稳定性好:检测结果一致性好,可重复性高
多样化/个性化:可定制,合成特异的抗原多肽片段,组合成各种 T 细胞选择性 MHC 四聚体
定性/定量分析:可结合流式细胞术实现对抗原特异性 T 细胞群的定性/定量分析
荧光标记选择灵活: 可选用 PE 或者 APC 标记
HelixGen MHC 四聚体试剂染色步骤
(一)所需主要试剂和设备
1)欲检测的细胞或全血;
2)荧光染料标记 Anti-CD8 抗体或其它抗体;
3)离心机、流式细胞分选仪等。
(二)基本操作流程
细胞准备
1.外周血单核细胞、脾细胞、淋巴细胞、常规细胞系细胞等,以 2-5×107/ml 的密度重悬于 FACS Buffer(PBS+ 2% 小牛血清+0.1% 叠氮钠;建议使用时新鲜配制),制备成细胞悬浮液。
2.取 25ul 细胞悬浮液滴加入微孔培养板或 FACS 试管。
Staining Cocktail 制备
3.制备 2X Staining Cocktail:FACS Buffer+ MHC 四聚体(建议稀释比例为 1:50~1:100)+ Anti-CD8/FITC 抗体或其他用作内参的抗体(请参考其说明书进行稀释)。
染色孵育
4.取 25ul 2X Staining Cocktail,滴加入步骤 2 中的微孔培养板或 FACS 试管,与细胞悬浮液混匀。(注意:使用移液器轻柔上下吹打混匀,尽可能避免产生气泡。)5.在冰上或其他已通过实验优化确认的最佳温度条件下,避光孵育 60 分钟。
洗涤
6、加入 150ul FACS Buffer 至微孔培养板每孔或 2-3 ml FACS Buffer 至 FACS 试管,轻柔混匀,避免形成气泡,1200 rpm 离心 5 min,小心除去上清液,尽可能不要触碰到细胞沉淀,减少细胞损失。(注意:对于具有传染性或危害性的样本,可考虑使用吸引器,轻柔吸掉上清液,尽可能不要触碰到细胞沉淀,减少细胞损失。)
7、重复步骤 6,再洗涤 2 次。
细胞固定&流式分析
8、将细胞重悬于 200ul 固定液(PBS+1% 多聚甲醛(PFA))中,使用流式细胞仪进行样本分析。
HelixGen MHC 四聚体试剂染色注意事项
1.染色体系的体积应尽可能小,以节约试剂。例如:25ul 2X Staining Cocktail + 25ul 细胞悬浮液=50ul。
2.所有操作应尽量在 4℃ 条件下进行。一些 MHC 四聚体在室温或更高温度条件下,能获得更高强度的亲和力,可提高染色效果。但另一些细胞表面标志物,比如 CD62L,对较高的温度条件往往比较敏感。部分 MHC 四聚体已被证实,在 37℃ 条件下容易与细胞解离。故我们建议:在 4℃ 条件下孵育 45-60 分钟,或在室温条件下孵育 30 分钟。
3.在进行大规模试验前,建议先进行预试验,以确定最佳的 MHC 四聚体稀释比例。通常,建议 MHC 四聚体的初始稀释比例为 1:100~1:200。请根据具体实验,优化其稀释比例,以期获得最佳的染色效果。
4.对于新鲜的外周血单核细胞、淋巴细胞、脾细胞,通常建议每个染色样品细胞总数为 1-2 ×106;而对于细胞克隆或者 CTL 细胞系,每个样品细胞总数可减低为 2×105。当针对细胞克隆染色时,建议选取具有不同特异性的其它克隆细胞作为阴性对照。
(本文转载:丁香园)




